武汉纺锤体实时成像纺锤体胚胎发育
纺锤体成像技术在细胞生物学领域具有很广的应用价值。以下是几个主要的应用方向:揭示纺锤体的精细结构和动态变化:纺锤体成像技术能够清晰地捕捉到纺锤体的精细结构和动态变化,如微管的排列、染色体的分离和纺锤体的形态变化等。这些观测结果不仅有助于揭示纺锤体的形成和功能机制,还为理解细胞分裂的复杂过程提供了新的视角。研究纺锤体相关疾病:纺锤体的异常与多种疾病的发生和发展密切相关,如遗传性疾病等。纺锤体成像技术能够实现对纺锤体结构和功能的精确观测,为揭示这些疾病的发病机制提供有力的支持。此外,该技术还可以用于评估药物对纺锤体的影响,为药物筛选提供新的思路和方法。辅助生殖技术:在临床诊疗中,纺锤体成像技术也被广泛应用于辅助生殖技术中。例如,在卵胞质内单精子注射(ICSI)过程中,纺锤体成像技术能够精确观测卵母细胞中纺锤体的位置,从而避免在精子时损伤纺锤体,提高受精率和临床妊娠率。 纺锤体微管与染色体上的动粒结合,形成稳定的连接。武汉纺锤体实时成像纺锤体胚胎发育
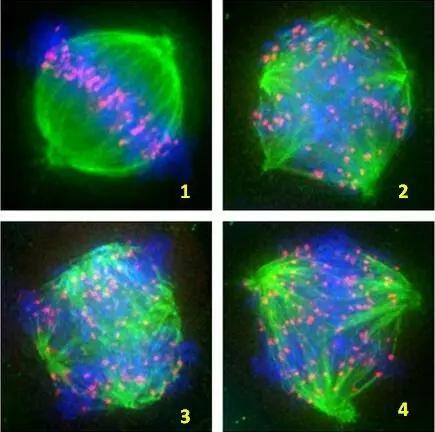
在有丝分裂中,纺锤体负责将姐妹染色单体分离并牵引至细胞两极,形成两个遗传物质完全相同的子细胞。而在减数分裂中,纺锤体则负责将同源染色体分离并牵引至细胞两极,形成四个遗传物质相似的子细胞。这一过程实现了遗传信息的重组和配子的形成。其次,在有丝分裂中,纺锤体的形成和分裂过程相对简单,主要依赖于中心体的复制和分离以及微管的动态生长和缩短。而在减数分裂中,纺锤体的形成和分裂过程则更加复杂。在减数分裂Ⅰ的前期,同源染色体需要发生配对、联会、交换和交叉等过程,这些过程都依赖于纺锤体的微管网络。此外,在减数分裂Ⅱ中,姐妹染色单体的分离也需要纺锤体的牵引和定位。此外纺锤体在有丝分裂和减数分裂中的形态和大小也存在差异。在有丝分裂中,纺锤体通常呈现出较为规则的纺锤形状,而在减数分裂中,纺锤体的形态则更加多样化,可能呈现出不规则的形状或分叉的形态。 美国无需染色纺锤体纺锤体的研究对于理解遗传信息的传递和维持具有重要意义。
通过抑制细胞周期重新进入,可以减少神经元的细胞凋亡,保护神经元的存活。例如,使用细胞周期抑制剂(如CDK抑制剂)可以抑制细胞周期重新进入,减少神经元的细胞凋亡。此外,通过促进神经元的细胞周期退出,也可以减少神经元的细胞凋亡。通过改善线粒体功能,可以恢复能量代谢,保护神经元的存活。例如,使用线粒体功能增强剂(如辅酶Q10)可以改善线粒体功能,恢复能量代谢。此外,通过减少线粒体的氧化应激,也可以改善线粒体功能。
纺锤体观测仪使ICSI更加安全可靠在进行单精子卵胞浆内注射(ICSI)授精时,**初人们观察人体内成熟的卵母细胞时,通常认为,卵母细胞纺锤**于***极体附近,故传统的ICSI操作是转动卵母细胞使其***极**于6点或12点处,然后在3点处注入精子。但是,在大量使用纺锤体观测仪后发现,***极体并不能很好地预测纺锤体的位置。一项研究提示,在ICSI后,用纺锤体观测仪观察纺锤体与***极体的夹角,结果发现小于30°这组卵母细胞的正常受精率更高。极体在卵周隙中的移动,或者纺锤体在胞质中的易位都使两者的位置关系发生改变,普通光学显微镜下ICSI穿刺部位的选择,可能会损伤纺锤体和(或)造成染色体的异常。通过纺锤体观测仪,可以精确地对卵母细胞中纺锤体的位置进行定位,从而避免在ICSI过程中损伤纺锤体,使ICSI更加安全可靠。有文献报道,在进行ICSI时,观察到“双折射纺锤体”的成熟卵母细胞的受精率和质量胚胎率***高于未观察到双折射纺锤体组。也有学者发现,有些卵母细胞在普通光学显微镜下看到是正常的,但在纺锤体观测仪这个“照妖镜”下,就能显出原形,表现为有***极体、但缺乏双折射的纺锤体,这类卵母细胞ICSI后的受精率和妊娠率极低。纺锤体在细胞分裂中的功能受到严格的时间和空间控制。
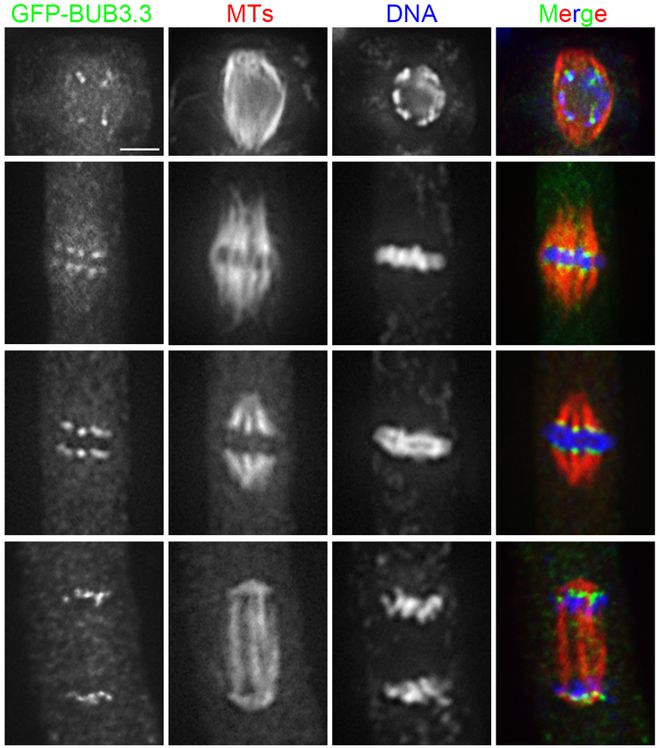
纺锤体的形成是一个复杂而精细的过程,涉及多种蛋白质的参与和调控。在有丝分裂的前间期,细胞进入S期,中心体开始复制倍增,为接下来的纺锤体形成做准备。进入G2期后,中心体完成复制,并在细胞进入分裂前期时分离,每个中心体各自形成放射状排列的微管,即星体。这些微管通过持续增加和丢失组成微管的微管蛋白亚基,实现微管的聚合和解聚,使纺锤体得以形成和维持。微管的组装和去组装过程受到多种调节蛋白的精确调控,如蛋白激酶、磷酸酶等。这些调节蛋白能够影响微管蛋白的聚合和解聚速率,从而控制纺锤体的形态和稳定性。此外,纺锤体的形成还依赖于动粒微管与染色体动粒的结合,这一过程由动粒上的驱动蛋白和动力蛋白介导,确保了染色体能够被纺锤体正确地捕获和牵引。 纺锤体的微管具有极性,一端为正端,另一端为负端。武汉无需染色纺锤体兼容大部分显微镜
纺锤体微管的聚合与解聚受到多种酶的调控。武汉纺锤体实时成像纺锤体胚胎发育
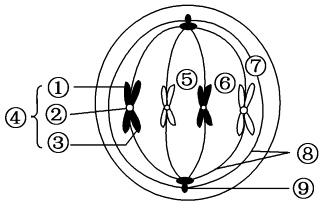
纺锤体生成在含中心体的细胞中,纺锤体的生成开始于细胞分裂前初期-即在细胞核膜分解(NuclearEnvelopeBreakdown,NEB)之前。初期的结构为两个**的以中心体为核的星状体(asters)。当细胞核膜分解后,染色体和星状体发生一系列复杂的互动反应。**终结果为所有的染色体在纺锤体的**(赤道板,)排列整齐,每两条染色体有一个着丝点,每一个着丝点被一束极性相同的微管(通常称为纺锤丝)附着。此时细胞处于分裂中期,纺锤体生成完毕。实验证明,中心体在这个过程中的作用不是必需的。动物细胞在中心体被激光捣毁后仍旧能够筑构纺锤体,但其位置通常不在细胞的大致几何中心,其后的胞质分裂也会受严重影响。纺锤体[1]在不含中心体的细胞中,纺锤体的生成是由染色体本身主导的。此过程由一小分子量的GTP连接蛋白(RanGTPase)控制。细胞核分解后,纺锤丝由染色体周围生成。其后这些纺锤丝会在动力分子与为微管动力的合作影响下自动排列为极性相反大致数目相同的两组。每组的极性相对于一组着丝点。同时在微管远端的动力蛋白dynein会将这些微管束集中到一点,形成纺锤极区(SpindlePolarZone)。与此同时,染色体会自动在赤道板排列整齐。纺锤体生成完毕。武汉纺锤体实时成像纺锤体胚胎发育
上一篇: 北京MII期纺锤体观测仪
下一篇: 上海纺锤体提高冷冻保存效率