无锡正规细胞外基质胶厂家
根据胶原的结构和功能可将其分为:1.跨膜性胶原(transmembrane collagen) 如ⅩⅦ型胶原,它有一个细胞内非胶原区,一个跨膜区和细胞外胶原尾巴。这种胶原主要由皮肤基底角化细胞产生,在肝脏中未发现。2.尚未分类的胶原:包括ⅩⅢ,ⅩⅤ和ⅩⅧ型胶原。ⅩⅢ型胶原主要分布于皮肤附属器、骨、软骨、横纹肌及肠道黏膜,但不见于肝脏。ⅩⅤ型胶原mRNA表达于许多组织和部位的成纤维细胞和上皮细胞。ⅩⅧ型胶原主要分布于肝脏、肺脏和肾脏。值得一提的是,原位杂交研究结果表明在肝脏中ⅩⅧ型胶原主要由肝实质细胞产生,显然与其它胶原主要由间质细胞产生不同。其羧基端具有克制血管增生的作用而称为内皮抑素或内皮它汀(endostatin),初步体外和动物试验发现它对部位有较强的克制作用。细胞外基质是动物组织的一部分, 不属于任何细胞。无锡正规细胞外基质胶厂家

细胞外基质:接着研究者为了实现不同功能EVs的随需释放,设计了一种由EVs组装而成的双层AH,将EVs与AH结合形成具有骨诱导的多相控释效应的BECM,并研究了BECM在体外对BMSCs的作用。活/死细胞染色显示活细胞比例无明显差异,说明BECM具有良好的生物相容性(图4A, B)。Transwell和CCK8实验表明,AH+C-EVs和BECM均促进了BMSCs的增殖和迁移。骨诱导7天后ALP染色及ALP活性检测显示,AH、AH+C-EVs、BECM均促进了ALP的表达(图4C-I)。为了在基因水平上评价各组成骨特性,检测了成骨标志物ALP、COL1A1、RUNX2在BMSCs中的表达,结果显示AH、AH+C-EVs和BECM均可促进成骨基因。合肥正规细胞外基质胶厂家一种是疏水短肽赋予分子以弹性;另一种短肽为富丙氨酸及赖氨酸残基的α螺旋。
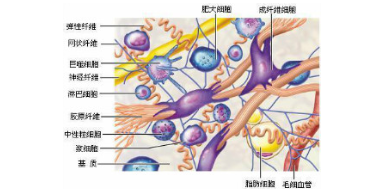
细胞外基质和胶原的结构:细胞外基质(extrcellulr mtrix, ECM)分为可溶性基质和不溶性基质。不溶性基 质由糖蛋白(glycoprotein)和蛋白多糖(proteoglycn, PG)交联在一起构成细胞外基质的骨架结构。可溶性基质由胶原蛋白组成,附着于不溶性基质上。随着创伤愈合研究 的深人,发现ECM不仅是维持组织结构的完整性所必需的骨架结构,还是伤口愈合过程中细胞迁移、增殖和分化的重要调节物质;而且,ECM还可与一些细胞因子发生协 同和拮抗作用,影响伤口的愈合。因此深入了解ECM中的成分在创伤修复时如何与成 纤维细胞、细胞因子发生联系,弄清其作用的分子机制,将有助于促进伤口的愈合并防 止瘢痕组织的出现。
细胞外基质层粘连蛋白:(laminin,LN)LN也是一种大型的糖蛋白,与Ⅳ型胶原一起构成基膜,是胚胎发育中出现较早的细胞外基质成分。LN分子由一条重链(α)和二条轻链(β、γ)借二硫键交联而成,外形呈十字形,三条短臂各由三条肽链的N端序列构成。每一短臂包括二个球区及二个短杆区,长臂也由杆区及球区构成。LN分子中至少存在8个与细胞结合的位点。例如,在长臂靠近球区的。链上有IKVAV五肽序列可与神经细胞结合,并促进神经生长。鼠LNα1链上的RGD序列,可与αvβ3整合素结合。现已发现7种LN分子,8种亚单位(α1,α2,α3,β1,β2,β3,γ1,γ2),与FN不同的是,这8种亚单位分别由8个结构基因编码。细胞外基质通过膜整合蛋白将细胞外与细胞内连成了一个整体。

细胞外基质重建你的身体:细胞外基质(extracellular matrix,ECM)是由细胞合成并分泌到胞外、分布在细胞表面或细胞之间的大分子,主要是一些多糖和蛋白,或蛋白聚糖。这些物质构成复杂的网架结构,支持并连接组织结构、调节组织的发生和细胞的生理活动。细胞外基质是动物组织的一部分,不属于任何细胞。它决定结缔组织的特性,为细胞的生存及活动提供适宜的场所,并通过信号转导系统影响细胞的形状、代谢、功能、迁移、增殖和分化。一旦它们召集到正确的细胞,基质便会展现它的另一大作用:它能依据细胞在基质内承受的张力,引导它们转化成骨骼细胞、肌肉细胞或脂肪细胞。这个张力是每日肌肉运动力量的附加产物。在实验室中,张力则是由人工操作基质硬度来完成。例如,高张力能够使所有进入的干细胞变成肌肉或骨骼,而在相对松弛的基质中,干细胞则会变成脂肪细胞。转化细胞接种入正常机体,常能长成块,并侵润正常组织,发生普遍转移。金华细胞外基质胶进货价
各种细胞脱离了细胞外基质呈单个游离状态时多呈球形。无锡正规细胞外基质胶厂家
细胞外基质(ECM)具有支持和诱导骨组织再生的功能,对骨组织再生具有重要意义。但是,在大多数骨缺损疾病中,影响细胞行为的细胞外基质(ECM)被破坏、改变或丢失,导致现有的包括骨结构模拟支架或生物活性因子在内的再生策略常常不能达到令人满意的结果。近年来研究发现,细胞外囊泡(EVs)作为细胞间通讯的介质,在体内外成骨过程中发挥着重要的作用。已经证明,间充质干细胞(MSCs)和成骨细胞来源的EVs通过传递DNA、RNA、酶和肽类直接调控成骨分化。此外, EVs具有良好的靶向性,可在特定位点发挥作用。与两种常用的主要策略(生物材料和细胞疗法)相比,EV避免了毒性和免疫原性问题,显示出了骨诱导潜能。近期,来自武汉大学的张玉峰教授团队开发一种具有骨诱导功能的仿生细胞外基质(BECM),不仅提供了细胞生长的力学支撑环境,而且释放功能性EVs,可诱导成骨和矿化,为骨再生提供了一种新的策略。无锡正规细胞外基质胶厂家