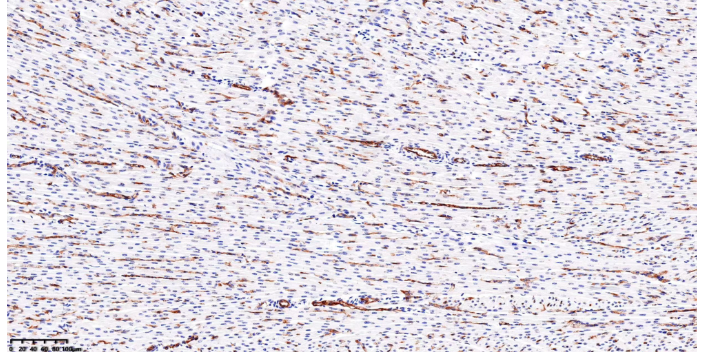
CTNT免疫荧光染色
免疫荧光Coons等于1941年初次采用荧光素进行标记而获得成功。这种以荧光物质标记抗体而进行抗原定位的技术称为荧光抗体技术。用荧光抗体示踪或检查相应抗原的方法称荧光抗体法;用已知的荧光抗原标记物示踪或检查相应抗体的方法称荧光抗原法。这两种方法总称免疫荧光技术,因为荧光色素不但能与抗体球蛋白结合,用于检测或定位各种抗原,也可以与其他蛋白质结合,用于检测或定位抗体,但是在实际工作中荧光抗原技术很少应用,所以人们习惯称为荧光抗体技术,或称为免疫荧光技术。以荧光抗体方法较常用。用免疫荧光技术显示和检查细胞或组织内抗原或半抗原物质等方法称为免疫荧光细胞(或组织)化学技术。免疫荧光技术可以用于研究药物的靶点和作用机制。CTNT免疫荧光染色
荧光效率:荧光分子不会将全部吸收的光能都转变成荧光,总或多或少地以其他形式释放。荧光效率是指荧光分子将吸收的光能转变成荧光的百分率,与发射荧光光量子的数值成正比。荧光效率=发射荧光的光量分子数(荧光强度)/吸收光的光量子数(激发光强度)。发射荧光的光量子数亦即荧光强度,除受激发光强度影响外,也与激发光的波长有关。各个荧光分子有其特定的吸收光谱和发射光谱(荧光光谱),即在某一特定波长处有较大吸收峰和较大发射峰。选择激发光波长量接近于荧光分子的较大吸收峰波长,且测定光波量接近于较大发射光波峰时,得到的荧光强度也较大。CTNT免疫荧光染色免疫荧光技术可以用于研究免疫相关疾病和自身免疫病。
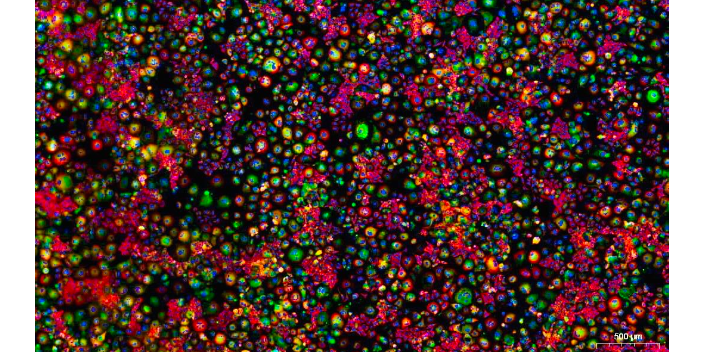
免疫荧光的制作:样品准备(贴壁细胞、悬浮细胞以及组织等):对于贴壁细胞:先将洁净的盖玻片在70%乙醇中进行浸泡处理,然后用干净无菌的镊子放置到培养皿中,用无菌PBS洗去残留的乙醇。待细胞接近长成单层后取出盖玻片,操作小心,防止细胞脱片。对于悬浮细胞:有2种方法,①先在悬浮液中进行固定步骤,然后把细胞滴加在载玻片上,干燥后细胞会紧贴在载玻片上。②先在悬浮液中进行固定和染色步骤,离心洗脱,然后用移液管移至盒式玻片进行后续染色步骤。对于冷冻切片:切片放置在载玻片上后,可以直接进行固定等后续操作。对于石蜡切片:免疫荧光中石蜡切片较少,要先进行脱蜡和抗原修复处理。
细胞和组织样品处理:准备荧光标记的细胞样品:为实现较佳的图像质量,首先应建立针对目的蛋白和细胞结构的研究,同时将其他一切背景等排除在图像之外。固定和破膜细胞样品用于标记–首先将细胞结构、蛋白和核酸固定,然后使荧光染料和抗体渗入到细胞内部,标记目的靶点。封闭细胞样品,防止荧光标记物与研究无关的蛋白非特异性结合,较大限度提高信噪比。蛋白封闭液有助于减少非特异染色。抗体能够取代封闭蛋白与其表位形成高亲和力结合,而封闭液可防止样品中的低亲和力结合。免疫荧光技术可以用于研究代谢疾病和内分泌系统的功能。

直接免疫荧光:单抗体(一抗)用于免疫染色和检测目标蛋白。荧光素结合的一抗直接与目标抗原结合,并使用成像显微镜观察。直接免疫荧光的优点:由于无需为两种抗体选择不同的物种反应性,从而降低了物种交叉反应性问题。与间接免疫荧光相比,时间缩短(操作步骤减少)。直接免疫荧光的缺点:不允许通过二抗进行信号放大;检测灵敏度降低;荧光素结合一抗的选择有限;与使用荧光二抗的检测相比,更昂贵。间接免疫荧光:使用两种抗体(一抗和二抗)进行免疫染色并检测目标蛋白。首先,用特异性一抗标记目标蛋白。然后,荧光素结合的二抗(与一抗具有不同的物种反应性)识别结合的抗原-抗体复合物并与一抗结合。由于一个以上的二抗可以与一抗结合,荧光信号被放大,提供了更高的检测灵敏度。免疫荧光技术可以用于研究细胞凋亡、细胞增殖和细胞分化等生物学过程。CTNT免疫荧光染色
免疫荧光技术可以用于研究细胞分裂和细胞周期。CTNT免疫荧光染色
免疫荧光间接法测抗体实验步骤:滴加0.01mol/L,pH7.4的PBS于已知抗原标本片,10min后弃去,使标本片保持一定湿度。滴加以0.01mol/L,pH7.4的PBS适当稀释的待检抗体标本,覆盖已知抗原标本片。将玻片置于有盖搪瓷盒内,37℃保温30min。取出玻片,置于玻片架上,先用0.01mol/L,pH7.4的PBS冲洗1-2次,然后按顺序过0.01mol/L,pH7.4的PBS三缸浸泡,每缸5min,不时振荡。取出玻片,用滤纸吸去多余水分,但不使标本干燥,滴加一滴一定稀释度的荧光标记的抗人球蛋白抗体。将玻片平放在有盖搪瓷盒内,37℃保温30min。重复操作3。取出玻片,用滤纸吸去多余水分,滴加一滴缓冲甘油,再覆以盖玻片。荧光显微镜高倍视野下观察,结果判定同直接法。CTNT免疫荧光染色